Недавно JAMA Oncology (IF 33.012) опубликовал важный результат исследования [1], проведенного группой профессора Цай Го-ринга из онкологической больницы университета Фудань и профессора Ван Цзина из больницы Жэньцзи медицинской школы университета Цзяотун в Шанхае в сотрудничестве с KUNYUAN BIOLOGY: «Раннее выявление молекулярной остаточной болезни и стратификация риска для колоректального рака стадии I-III с помощью метилирования циркулирующей опухолевой ДНК и стратификации риска)». Это исследование является первым многоцентровым исследованием в мире, в котором применяется технология мультигенного метилирования ctDNA крови на основе ПЦР для прогнозирования рецидива колоректального рака и мониторинга рецидива, обеспечивая более экономически эффективный технический путь и решение по сравнению с существующими методами технологии обнаружения MRD, что, как ожидается, значительно улучшит клиническое использование прогнозирования и мониторинга рецидива колоректального рака и значительно улучшит выживаемость и качество жизни пациентов. Исследование также получило высокую оценку журнала и его редакторов и было включено в список ключевых рекомендательных статей этого номера. Для рецензирования были приглашены профессор Хуан Руис-Баньобре из Испании и профессор Аджай Гоэль из США. Об исследовании также сообщил GenomeWeb, ведущий биомедицинский ресурс в США.

Колоректальный рак (КРР) является распространенной злокачественной опухолью желудочно-кишечного тракта в Китае. Данные Международного агентства по изучению рака (МАИР) за 2020 год показывают, что 555 000 новых случаев в Китае составляют около 1/3 от общего числа случаев в мире, причем уровень заболеваемости подскакивает на второе место среди распространенных видов рака в Китае; 286 000 смертей составляют около 1/3 от общего числа случаев в мире, занимая пятое место среди наиболее распространенных причин смерти от рака в Китае. Пятая причина смерти в Китае. Примечательно, что среди диагностированных пациентов стадии TNM I, II, III и IV составляют 18,6%, 42,5%, 30,7% и 8,2% соответственно. Более 80% пациентов находятся на средней и поздней стадиях, а 44% из них имеют одновременные или гетерохронные отдаленные метастазы в печень и легкие, что серьезно влияет на период выживаемости, ставит под угрозу здоровье наших жителей и вызывает тяжелое социально-экономическое бремя. Согласно статистике Национального онкологического центра, среднегодовой рост стоимости лечения колоректального рака в Китае составляет от 6,9% до 9,2%, а личные расходы пациентов на здравоохранение в течение года после постановки диагноза могут составлять до 60% семейного дохода. Онкологические больные страдают от болезни и испытывают серьёзное экономическое давление [2].
Девяносто процентов очагов колоректального рака можно удалить хирургическим путем, и чем раньше обнаружена опухоль, тем выше пятилетняя выживаемость после радикальной хирургической резекции. Однако общая частота рецидивов после радикальной резекции по-прежнему составляет около 30%. Пятилетняя выживаемость при колоректальном раке среди населения Китая составляет 90,1%, 72,6%, 53,8% и 10,4% для стадий I, II, III и IV соответственно.
Минимальная остаточная болезнь (МОБ) является основной причиной рецидива опухоли после радикального лечения. В последние годы технология выявления МОБ при солидных опухолях стремительно развивается, и несколько авторитетных наблюдательных и интервенционных исследований подтвердили, что послеоперационный статус МОБ может указывать на риск послеоперационного рецидива колоректального рака. Преимуществом цоДНК-тестирования является неинвазивность, простота, быстрота, высокая доступность образца и возможность преодоления гетерогенности опухоли.
В рекомендациях NCCN США по раку толстой кишки и в рекомендациях CSCO Китая по колоректальному раку указано, что для определения риска послеоперационного рецидива и выбора адъювантной химиотерапии при раке толстой кишки тестирование ctDNA может предоставить прогностическую и предсказательную информацию, помогающую в принятии решений о назначении адъювантной терапии пациентам со II или III стадией рака толстой кишки. Однако большинство существующих исследований сосредоточено на мутациях ctDNA, основанных на технологии высокопроизводительного секвенирования (NGS), которая отличается сложностью процесса, длительным временем выполнения и высокой стоимостью [3], а также некоторой недостаточной обобщаемостью и низкой распространенностью среди онкологических пациентов.
Для пациентов с колоректальным раком III стадии динамический мониторинг ctDNA на основе NGS стоит до 10 000 долларов США за один визит и требует ожидания до двух недель. Благодаря мультигенному тесту на метилирование, использованному в данном исследовании, ColonAiQ®, пациенты могут пройти динамический мониторинг ctDNA в десять раз дешевле и получить результат всего за два дня.
Согласно 560 000 новых случаев колоректального рака в Китае каждый год, наиболее острая потребность в динамическом наблюдении наблюдается у клинических пациентов, в основном с колоректальным раком II-III стадии (доля составляет около 70%), в связи с чем объем рынка динамического мониторинга колоректального рака MRD достигает миллионов людей каждый год.
Результаты исследования имеют важное научное и практическое значение. Масштабные проспективные клинические исследования подтвердили, что технология ПЦР-анализа метилирования нескольких генов ctDNA в крови может быть использована для прогнозирования и мониторинга рецидивов колоректального рака с высокой чувствительностью, оперативностью и экономической эффективностью, что позволяет прецизионной медицине оказывать помощь большему числу онкологических пациентов. Исследование основано на тесте ColonAiQ®, тесте метилирования нескольких генов для колоректального рака, разработанном Университетом Нью-Йорка (KUNY), клиническая ценность которого для раннего скрининга и диагностики подтверждена централизованным клиническим исследованием.
Gastroenterology (IF33.88), ведущий международный журнал в области желудочно-кишечных заболеваний в 2021 году, сообщил о результатах многоцентрового исследования больницы Чжуншань при университете Фудань, онкологической больницы при университете Фудань и других авторитетных медицинских учреждений совместно с KUNYAN Biological, которые подтвердили превосходную эффективность ColonAiQ® ChangAiQ® при раннем скрининге и ранней диагностике колоректального рака и изначально исследовали его потенциальное применение в мониторинге прогноза колоректального рака.
Для дальнейшей проверки клинического применения метилирования ctDNA при стратификации риска, принятии решений о лечении и раннем мониторинге рецидивов при колоректальном раке I–III стадии исследовательская группа включила 299 пациентов с колоректальным раком I–III стадии, перенесших радикальную операцию, и собирала образцы крови в каждой точке наблюдения (с интервалом в три месяца) в течение одной недели до операции, одного месяца после операции и в ходе послеоперационной адъювантной терапии для динамического тестирования ctDNA крови.
Во-первых, было обнаружено, что тестирование ctDNA может предсказать риск рецидива у пациентов с колоректальным раком на ранней стадии, как до операции, так и в раннем послеоперационном периоде. У пациентов с положительным результатом на дооперационном этапе вероятность послеоперационного рецидива была выше, чем у пациентов с отрицательным результатом на дооперационном этапе (22,0% > 4,7%). Раннее послеоперационное тестирование ctDNA по-прежнему предсказывало риск рецидива: через месяц после радикальной резекции у пациентов с положительным результатом на ctDNA вероятность рецидива была в 17,5 раз выше, чем у пациентов с отрицательным результатом; группа также обнаружила, что комбинированное тестирование ctDNA и CEA немного улучшило эффективность выявления рецидива (AUC = 0,849), но разница не была значимой по сравнению с тестированием только ctDNA (AUC = 0,839) Разница не была значимой по сравнению с тестированием только ctDNA (AUC = 0,839).
Клиническая стадия в сочетании с факторами риска в настоящее время является основной основой для стратификации риска онкологических больных, и в текущей парадигме большое количество пациентов все еще рецидивируют [4], и существует острая необходимость в лучших инструментах стратификации, поскольку в клинике сосуществуют избыточное и недостаточное лечение. Исходя из этого, группа классифицировала пациентов с колоректальным раком III стадии на различные подгруппы на основе клинической оценки риска рецидива (высокий риск (T4/N2) и низкий риск (T1-3N1)) и периода адъювантного лечения (3/6 месяцев). Анализ показал, что у пациентов в подгруппе высокого риска ctDNA-позитивных пациентов частота рецидивов была ниже, если они получали шесть месяцев адъювантной терапии; в подгруппе низкого риска ctDNA-позитивных пациентов не было значительной разницы между циклом адъювантного лечения и результатами лечения пациентов; в то время как у ctDNA-отрицательных пациентов прогноз был значительно лучше, чем у ctDNA-положительных пациентов, и наблюдался более длительный безрецидивный период после операции (RFS); колоректальный рак стадии I и стадии низкого риска II. У всех ctDNA-отрицательных пациентов не было рецидивов в течение двух лет; поэтому ожидается, что интеграция ctDNA с клиническими характеристиками дополнительно оптимизирует стратификацию риска и лучше спрогнозирует рецидив.
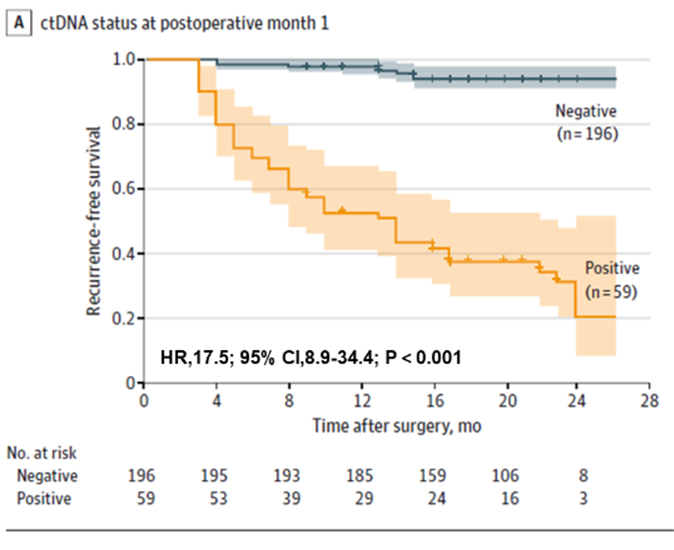
Рисунок 1. Анализ плазменной ДНК на стадии POM1 для раннего выявления рецидива колоректального рака
Дальнейшие результаты динамического тестирования ctDNA показали, что риск рецидива был значительно выше у пациентов с положительным динамическим тестированием ctDNA, чем у пациентов с отрицательным ctDNA во время фазы мониторинга рецидива заболевания после окончательного лечения (после радикальной операции + адъювантной терапии) (рисунок 3ACD), и что ctDNA может указывать на рецидив опухоли на 20 месяцев раньше, чем визуализация (рисунок 3B), что дает возможность раннего выявления рецидива заболевания и своевременного вмешательства.
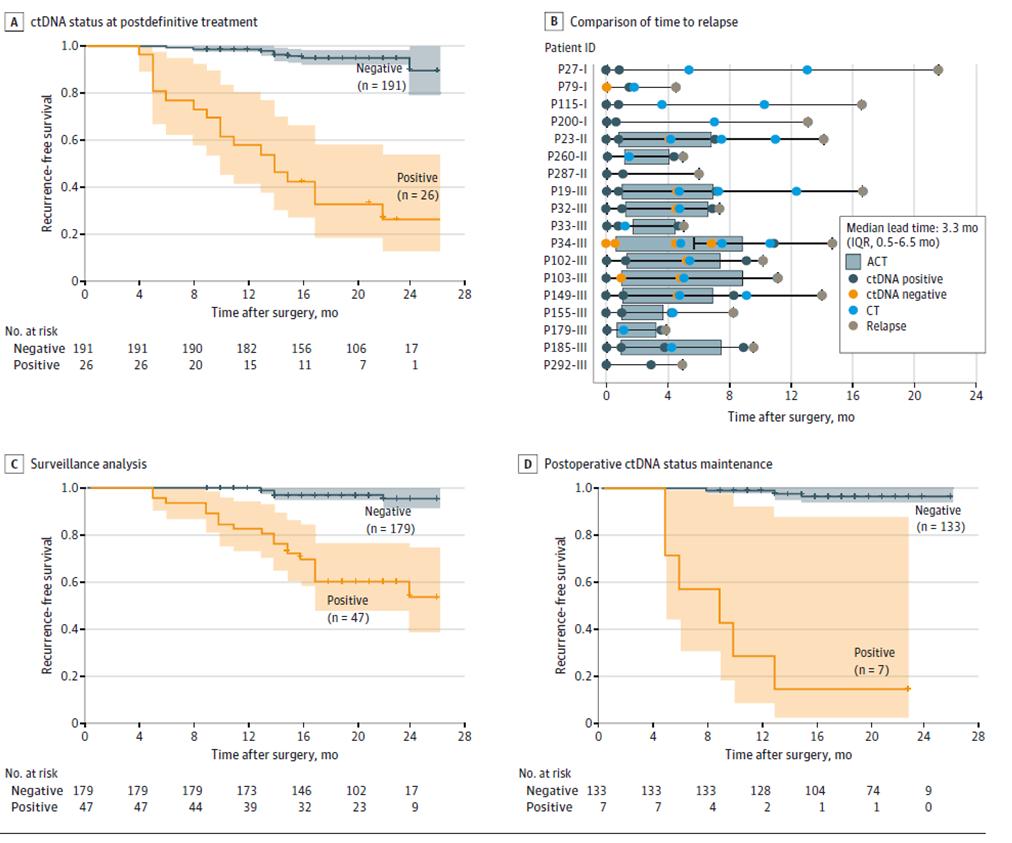
Рисунок 2. Анализ ctDNA на основе продольной когорты для выявления рецидива колоректального рака
«Большое количество исследований трансляционной медицины в области колоректального рака лидируют в этой дисциплине, особенно тестирование МОБ на основе ctDNA, которое демонстрирует большой потенциал для улучшения послеоперационного ведения пациентов с колоректальным раком, позволяя проводить стратификацию риска рецидива, принимать решения по лечению и осуществлять ранний мониторинг рецидива.
Преимущество выбора метилирования ДНК в качестве нового маркера МОБ по сравнению с обнаружением мутаций заключается в том, что он не требует скрининга полногеномного секвенирования опухолевых тканей, используется непосредственно для анализа крови и позволяет избежать ложноположительных результатов из-за обнаружения соматических мутаций, происходящих из нормальных тканей, доброкачественных заболеваний и клонального кроветворения.
Это исследование и другие связанные с ним исследования подтверждают, что тестирование МОБ на основе ctDNA является наиболее важным независимым фактором риска рецидива колоректального рака I–III стадии и может использоваться для принятия решений о лечении, включая «эскалацию» и «понижение» адъювантной терапии. МОБ является наиболее важным независимым фактором риска рецидива после операции по поводу колоректального рака I–III стадии.
Область МОБ стремительно развивается благодаря появлению ряда инновационных, высокочувствительных и специфичных методов анализа, основанных на эпигенетике (метилирование ДНК и фрагментомика) и геномике (сверхглубокое таргетное секвенирование или секвенирование всего генома). Мы ожидаем, что ColonAiQ® продолжит организовывать масштабные клинические исследования и сможет стать новым индикатором для тестирования МОБ, сочетающим доступность, высокую производительность и экономичность, а также способным широко применяться в повседневной клинической практике.
Ссылки
[1] Мо С, Е Л, Ван Д, Хан Л, Чжоу С, Ван Х, Дай В, Ван И, Ло В, Ван Р, Сю И, Цай С, Лю Р, Ван З, Цай Г. Раннее выявление молекулярной остаточной болезни и стратификация риска для колоректального рака стадии I–III с помощью метилирования циркулирующей опухолевой ДНК. JAMA Oncol. 20 апреля 2023 г.
[2] «Бремя колоректального рака среди населения Китая: изменилось ли оно за последние годы?», Китайский журнал эпидемиологии, том 41, № 10, октябрь 2020 г.
[3] Таразона Н., Химено-Валиенте Ф., Гамбарделла В. и др. Целенаправленное секвенирование нового поколения циркулирующей опухолевой ДНК для отслеживания минимальной остаточной болезни при локализованном раке толстой кишки. Ann Oncol. 1 ноября 2019 г.;30(11):1804-1812.
[4] Тайеб Дж., Андре Т., Оклин Э. Совершенствование адъювантной терапии неметастатического рака толстой кишки, новые стандарты и перспективы. Cancer Treat Rev. 2019;75:1-11.
Время публикации: 28 апреля 2023 г.
 中文网站
中文网站